OCTについて
光干渉断層撮影法(OCT)は、近赤外線を用いて冠動脈を高い解像度で撮像する画像診断法であり、冠動脈疾患の病変の特徴やプラークの組織性状を把握することが可能です。OCTでは高精度の測定が自動的に実行され、ステントのサイズ決定やステント留置後の至適化に役立ちます1。
OCTソフトウェア — 直感的なユーザーインターフェース
Ultreon™ ソフトウェアには、人工知能(AI)*と自動検出・自動測定機能が備わっています。また、強化された分析機能だけでなく、直感的でシンプルなユーザーインターフェースです。
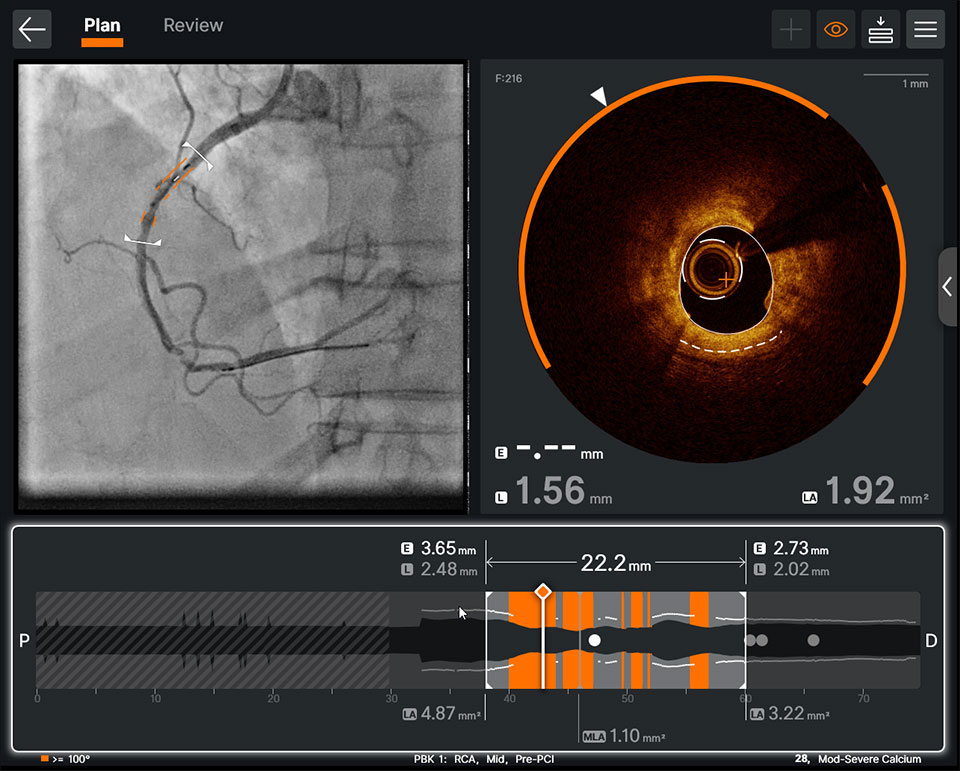
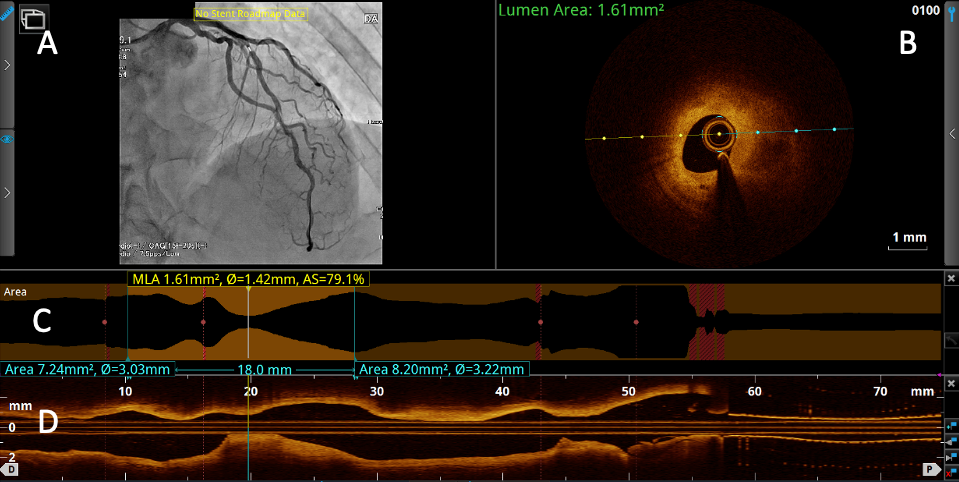
Ultreon™ソフトウェアのユーザーインターフェース。Pre-PCIのOCTプルバック:AIを活用した血管内腔のOCTデータをアンギオ画像と統合することで、石灰化プラークの特定に役立ちます。
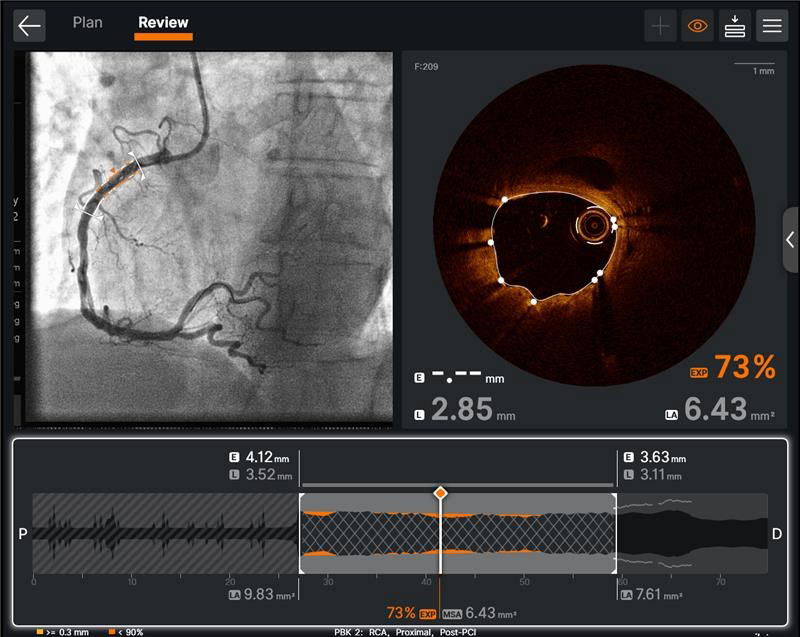
Ultreon™ソフトウェアのユーザーインターフェース。Post-PCIのOCTプルバック: OCT ソフトウェアは、PCI 後の治療解析データを提供し、留置されたステントの至適化をサポートします。
OCT は PCI の治療戦略をどのようにサポートしていますか?
- Pre OCT Pullback では、原因病変を特定し、病変の形態を評価して適切な治療戦略を選択。ステントのランディングゾーンを位置決めし、バルーンとステントの至適なサイズの選択をサポートします2。
- Post OCT Pullbackでは、ステントダイセクションやプラークプロトリュージョン、マルアポジション(不完全圧着)などを詳細に評価することで、ステント血栓症の回避に役立ちます3。このように、OCTはステントが十分に拡張され、ステント留置の最適化を支援します1。
OCTによるPCIの治療戦略は、MLD-MAXと呼ばれるOCTアルゴリズム(組織性状、病変長、血管径、中膜解離、ステントアポジション、ステント拡張)により、エビデンスに基づいたワークフローによって適切なステント拡張を支援します。MLD-MAXにより迅速で一貫した手技と良好な予後に役立ちます6。
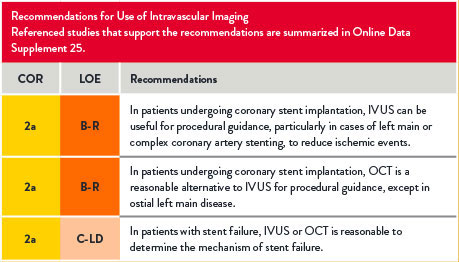
For references, refer to the original document.

OCTを採用する理由
PCIのガイドとしてOCTとMLD-MAXワークフローを使用することで、組織性状の評価、血管の前処置方針、ステントサイズの判断を支援します。また、OCTによる診断は、最終的なステント拡張の方針や2、有害事象となる主要な予測因子を理解するのに役立ちます3。
MLD-MAXについて
MLD-MAXは標準化された段階的なOCTワークフローで、PCI施行前後における治療判断の指針となります。
6文字からなるMLD-MAXは、最大限のステント拡張を行って至適な結果を得るというPCIの目標における6段階を表しています。PCI施行前に行われる最初の3段階(MLD)は治療方針の参考となること、またPCI施行後に行われる残りの3段階(MAX)はステント留置を至適化することを目的としています。MLD-MAXは LightLab Clinical Initiativeの一環として開発されたものです。
至適な拡張を得ることによってPCI施行時の主要心血管イベントの発現率を軽減できることが報告されています2。画像診断により確認される適切な拡張状態は、安全性と有効性の点で有益です4。
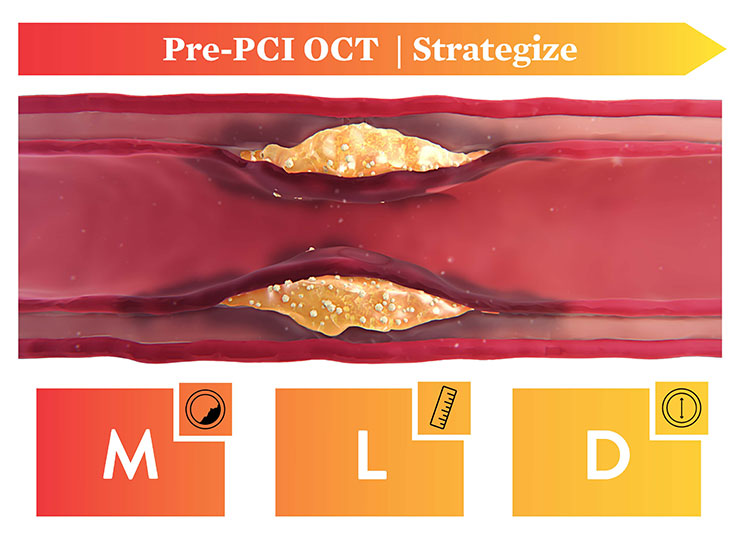
Morphology
(組織性状)
高度石灰化を特定1
Length
(病変長)
健康な組織/EEL可視化によってランディングゾーンを選択2
Diameter
(血管径)
血管径、ステント径、バルーン径を測定1
基準:
180度超、厚さ0.5 mm超、長さ5 mm超
健康な組織(EEL可視化)にランディングゾーンを設定
注:健康な組織にあたるEELが認められない場合には、TCFAの領域または脂質プールを避けて最大の内腔を特定し、これらの高リスク領域へのステントエッジの配置を避ける3
遠位基準測定値を使用してステント径を選択
遠位バルーンでは遠位基準測定値を使用、近位バルーンでは近位基準測定値を使用
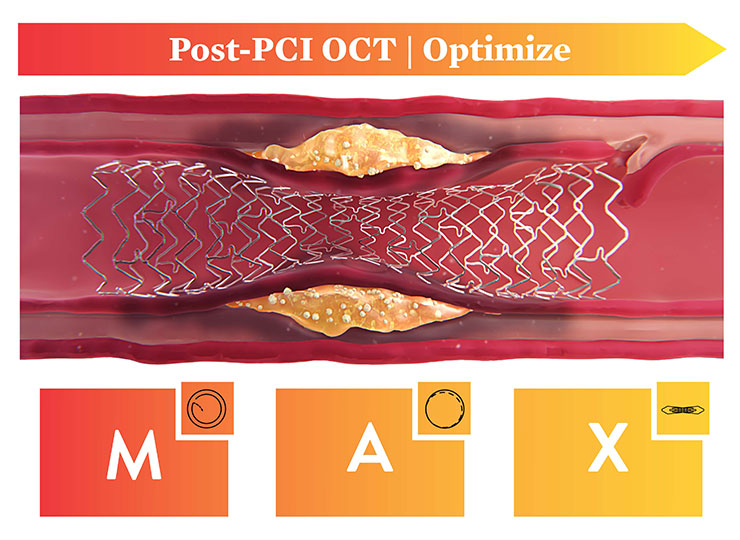
Medial Dissection
(中膜解離)
重大な解離に対処2
Apposition
(ステントアポジション)
広範な圧着不良に対処
Xpansion
(ステント拡張)
拡張を確認3,6
基準:
解離が中膜層を貫通、1四分円弧以上
基準:
圧着不良インジケータに長さ3 mm4を超える顕著な(壁部から0.3 mm以上5)不完全圧着が認められる
基準:
80%以上で可、90%以上で最適
1. Fujino, A. et al. A new optical coherence tomography-based calcium scoring system to predict stent under expansion. EuroIntervention, April 2018; 13(18):e2182-e2189. 2. Prati, F. et al. The CLI-OPCI II Study. JACC: Cardiovascular Imaging, 2015: Vol 8, No. 11:1297-305. 3. Kubo, T. et al. Application of Optical Coherence Tomography in Percutaneous Coronary Intervention. Circulation Journal, September 2012: Vol. 76, 2076-2083. 4. Ali, Z. et al. ILUMIEN III: Optimize PCI. Lancet 2016, 388:2618-2628. 5. Souteyrand, G. et al. PESTO French Registry. European Heart Journal, 2016:37:1208-1216. 6. Meneveau, N. et al. DOCTORS Study. Circulation, September 2016, 134:906-917.; Zhang, J. et al. The ULTIMATE Trial. Journal of the American College of Cardiology, Dec 2018: Vol 72, No 24:3126-37.; Russo, R. et al. The AVID Trial. Circ Cardiovasc Intervent, April 2009; 2:113-123.; De Jaegere, P. et al. MUSIC Study. European Heart Journal, February 1998:19,1214-1223.

*Ultreon™機能の一部
参考文献
- Reyes, M. The next innovation in PCI is not a stent. The value of OCT. CathLab Digest. Oct 6, 2019. Volume 27, Issue 10.
- Räber L, et al. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018;39(35):3281-3300.
- Bezerra, H. et al: Analysis of changes in decision-making process during OCT-guided PCI -Insights from the LightLab Initiative. EuroPCR2020 Presentation.
- Zhang J, et al. Intravascular ultrasound versus angiography-guided drug-eluting stent implantation: the ULTIMATE trial. J Am Coll Cardiol. 2018;72(24):3126-3137.
販売名:SJM FD-OCT Integratedイメージングシステム
医療機器承認番号:22700BZX00153000
分類:管理医療機器
販売名:SJM FD-OCT イメージングシステム
医療機器承認番号:22300BZX00306000
分類:管理医療機器
販売名:SJM OCT イメージングカテーテル
医療機器承認番号:22300BZX00307000
分類:高度管理医療機器
販売名:ドラゴンフライ オプスター OCT イメージングカテーテル
医療機器承認番号:30100BZX00237000
分類:高度管理医療機器
MAT-2501359 v1.0
