製品概要
ProStyle™ 製品概要
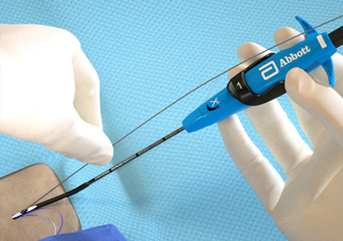
多様な用途
プレクローズ、ポストクローズの選択が可能
手技の最後までガイドワイヤーアクセスを残すことで、止血不全時のリカバリーが可能

安全性
血管内腔の維持
ポリプロピレン製縫合糸の採用により血栓リスクの低下が期待されます1
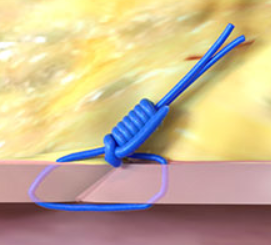 QOLの向上
QOLの向上
手技時間の短縮、入院期間の短縮が可能であることが示されています2,3
術後の疼痛軽減、鎮痛剤使用料の低下、瘢痕化リスク低下に貢献することが示されています4
1. Mercandetti, Michael. Wound Healing and Repair. Medscape. WebMD, 19 May 2017. Web. March 21, 2018.
2. Kawashima, Hideyuki et al. “Propensity-matched comparison of percutaneous and surgical cut-down approaches in transfemoral transcatheter aortic valve implantation using a balloon-expandable valve.” EuroIntervention : journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology vol. 12,16 (2017): 1954-1961. doi:10.4244/EIJ-D-16-00408
3. Taku Ishibashi et al. “Safety and utility of total percutaneous endovascular aortic repair with a single Perclose ProGlide closure device.” J Vasc Surg . 2016 Mar;63(3):585-8.
4. Nelson, Peter R., et al. “A multicenter, randomized, controlled trial of totally percutaneous access versus open femoral exposure for endovascular aortic aneurysm repair (the PEVAR trial).” Journal of vascular surgery 59.5 (2014): 1181-1193.
8Fを超える血管アクセス部の止血を実現するプレクローズ法
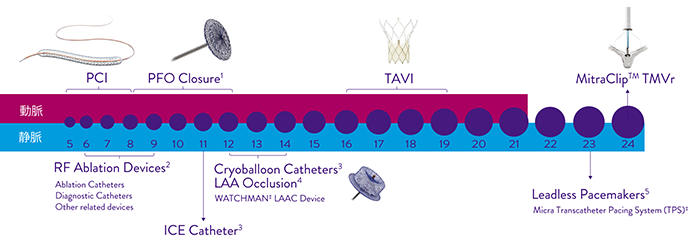
Boston Scientific Corporation. WATCHMAN‡ LAAC Device, Medtronic plc. Micra‡ IFU. 1. Abbott Structural Heart Products: U.S. IFUs (AMPLATZER™ PFO Occluder (8F-12F) 2. Abbott EP Products: U.S. IFUs (Agilis™ NxT steerable introducer (8.5F), TactiCath™ Contact Force family of ablation catheters (7F/8F), FlexAbility™ irrigated ablation catheter (8F), Advisor™ HD Grid Mapping Catheter, Sensor Enabled™ (8F), ViewFlex™ Xtra ICE Catheter (10F) 3. Arctic Front‡ family of Cryoballoons: ≥12F sheath as per Product Brochure 4. The WATCHMAN‡ Left Atrial Appendage Closure (LAAC) Device (Boston Scientific): 12F/14Fare for both access and delivery systems, as per Product Brochure 5. Micra‡ TPS (Medtronic, Inc.): 23F sheath as per Product Brochure
Perclose™ ProStyle™ - 材料価格算定に関する留意事項
機能区分:107 経皮的血管形成術用穿刺部止血材料
経皮的血管形成術用穿刺部止血材料のうち、薬事承認又は認証上、類別が「医療用品(2)縫合糸」であって、一般的名称が「非吸収性縫合糸セット」であるものについては、経皮的カテーテル処置を実施した患者の早期離床を目的とした大腿 動脈 穿刺部位又は大腿静脈 穿刺部位の止血を行う場合であって、次のいずれかに該当する場合に算定できる。なお、経皮的血管形成術用穿刺部止血材料を使用する医療上の必要性について、診療報酬明細書の摘要欄に記載する こと。
<5Fr以上8Fr以下のイントロデューサーを使用した症例>
5Fr 以上 8Fr 以下のイントロデューサーシースを使用した場合、1セット についてのみ算定できる。
<8Frを超えるイントロデューサーを使用した症例>
8Frを超えるイントロデューサーシースを使用した症例であって、大腿動脈穿刺部位又は大腿静脈穿刺部位の止血を行った場合、一連につき 2セット まで算定できる。
ただし、K556-2、K559-2、K561 の2のロ、K561 の2のハ、K574-2、K594の4のハ及びK595の1については、一連につき 4セット まで算定できる。
| 関連手術区分番号 (Kコード) ならびに手技名 | |
|---|---|
| K556-2 | 経皮的大動脈弁拡張術 |
| K559-2 | 経皮的僧帽弁拡張術 |
| K561の2のロ | ステントグラフト内挿術 (腹部大動脈) |
| K561の2のハ | ステントグラフト内挿術 (腸骨動脈) |
| K574-2 | 経皮的心房中隔欠損閉鎖術 |
| K594の4のハ | 不整脈手術 (左心耳閉鎖術・経カテーテル的手術によるもの) |
| K595の1 | 経皮的カテーテル心筋焼灼術 (心房中隔穿刺又は心外膜アプローチを伴うもの) |
「特定保険医療材料及びその材料価格(材料価格基準)の一部改正に伴う特定保険医療材料(使用歯科材料料)の算定について」(令和4年3月4日保医発0304第10号)の一部改正について(令和5年9月29日付け保医発0929第1号)
本WEBページ上の製品画像は全てイメージ図です。実際の縮尺とは違いがあります。
販売名: パークローズ ProStyle
医療機器承認番号: 30300BZX00158000
分類:高度管理医療機器
MAT-2113952 v9.0

